東京大学:ヒトiPS未分化細胞の培養:超高密度化に成功(動画):
Tokyo Univ:Culture of undifferentiated human iPS cells:ultrahigh density:
东京大学:未分化人类iPS细胞培养:超高密度成功
ー細胞あたりの培養コストを1/8に低減ー
東京大学大学院
酒井康行教授研究グループは、
- カネカ、日産化学との共同で、
- ヒトiPS細胞の未分化増殖のコストを、
- 1/8に低減する小規模培養システムを開発した。
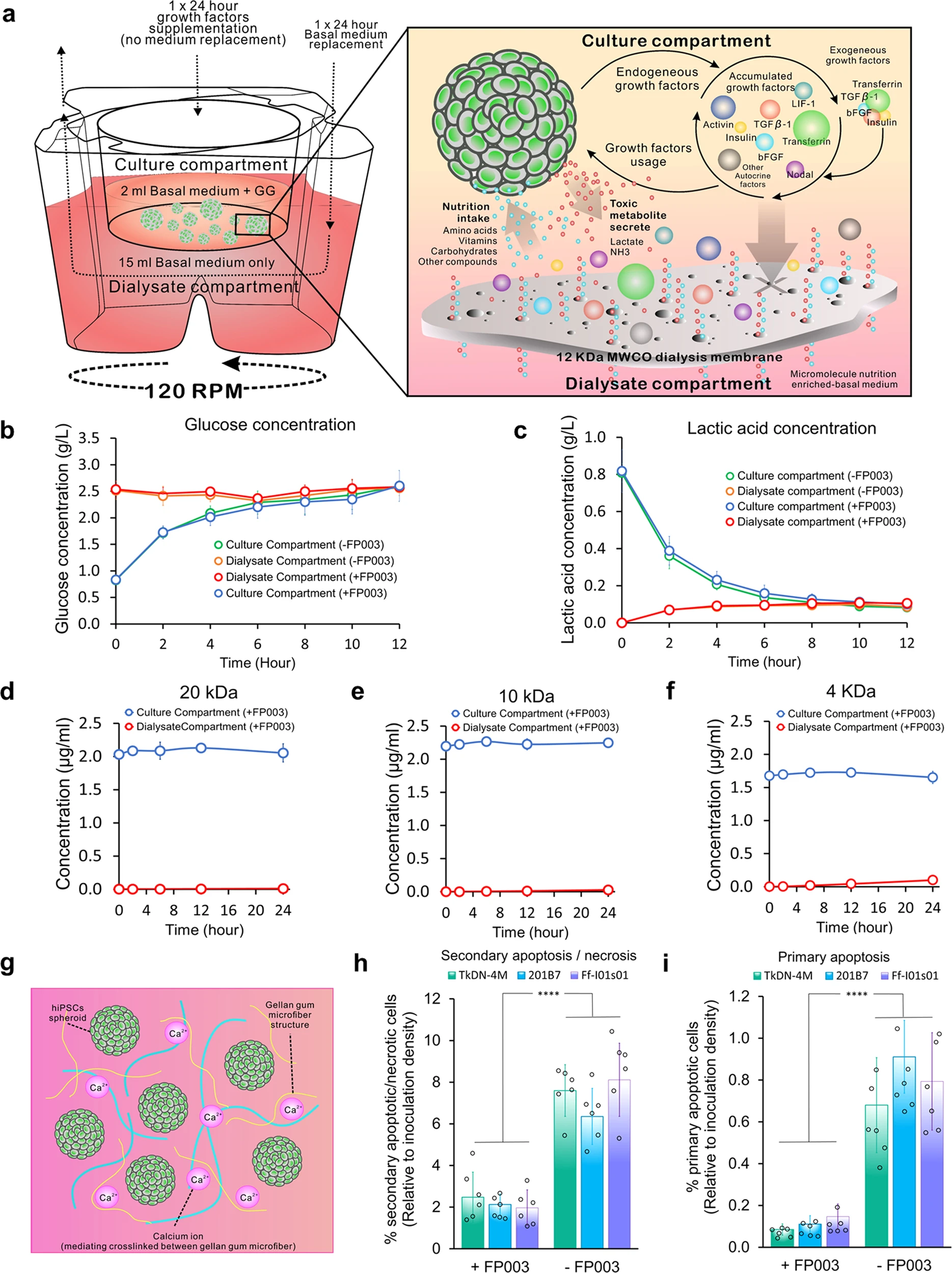
小規模培養システム:
「透析膜で仕切られた上下2つの空間」を持ち、その上部で細胞を培養する。
- そこに増殖因子を溜めておき、
- 栄養素や老廃物は下部と行き来できる。
「ここに多糖を添加すること」で、増殖を従来の8倍に高密度化できた。
iPS細胞増殖因子の価格:
iPS細胞は、再生医療で大いに期待されている。
- しかし、iPS細胞増殖因子の価格が高い。
- そのことが。未分化細胞の大量増殖のネックになっている。
透析膜による培養手法:
だが、増殖密度が低かったり、コストの削減が実現されていない。
研究グループの新手法:
高価な増殖因子を、フルに使える構造になっている。
細胞培養実験の結果:
- iPS細胞から「自己組織化能の現れ」として、
- iPS細胞が分泌する増殖因子「Nordal」濃度が、
- 培養につれ増加する現象が認められた。
これが大量の細胞培養につながった。
臓器細胞への分化誘導:
今後、細胞培養のより高密度化を進める。
「数十倍のコストがかかる臓器細胞への分化誘導」に、
「この方式が有効に働くかの検討」を行う。
すでに、未発表ながら、
「肝臓や膵島分化第一段階(内胚葉分化)」で、
「増殖因子の使用量を1/8程度に低減させること」に成功した。
TechCrunch Japan
https://jp.techcrunch.com/2021/11/24/tokyo-univ-ips-cell-high-density-cultivation/
A miniature dialysis-culture device allows high-density human-induced pluripotent stem cells expansion from growth factor accumulation
Communications Biology
Abstract
Three-dimensional aggregate-suspension culture
is a potential biomanufacturing method to produce a large number of human induced pluripotent stem cells (hiPSCs);
however,
the use of expensive growth factors and method-induced mechanical stresspotentially result in inefficient production costs and difficulties in preserving pluripotency, respectively.
Here,
we developed a simple, miniaturized, dual-compartment dialysis-culture device based on a conventional membrane-culture insert with deep well plates.The device improved cell expansion up to approximately ~3.2 to 4×107 cells/mL.
The high-density expansion
was supported by reduction of excessive shear stress and agglomeration mediated by the addition of the functional polymer FP003.The results revealed accumulation of several growth factors,
including fibroblast growth factor 2 and insulin, along with endogenous Nodal, which acts as a substitute for depleted transforming growth factor-β1 in maintaining pluripotency.
Because we used the same growth-factor formulation per volume in the upper culture compartment,
the cost reduced in inverse proportional manner with the cell density.
We showed that
growth-factor-accumulation dynamics in a low-shear-stress environment successfully improved hiPSC proliferation, pluripotency, and differentiation potential.This miniaturised dialysis-culture system
demonstrated the feasibility of cost-effective mass production of hiPSCs in high-density culture.