京大:iPS細胞をがん免疫療法に活用:キラーT細胞を増殖(動画):
Kyoto Univ: iPS cells for cancer immunotherapy: Proliferating T cells:
京都大学:利用 iPS 细胞进行癌症免疫治疗:增殖杀伤性 T 细胞
ーがん免疫療法の費用を10分の1以下にー
がん免疫療法:
- 体内でがん細胞を攻撃するキラーT細胞を、
- 患者やドナーから移植する「免疫療法」が、
- 有効とされています。
しかし、従来から高額費用などが課題となっています。
京都大学iPS細胞研究所
金子新教授らのグループiPS細胞を用いて、T細胞の増殖を目指していました。
しかしこれまで「増殖させる過程で、がん細胞への攻撃性」が、低下していました。
IL21という物質:
そこで、IL21という物質を加えて、T細胞を増殖させました。
「IL21により、攻撃性を維持させることに成功した」ということです。
T細胞の大量作製:
金子教授は、
T細胞の大量作製が可能になれば、従来の10分の1以下の費用で、
免疫療法を受けられると話しています。
https://www.fnn.jp/articles/-/253309
「高い増殖性を持つキラーT細胞クローン」を作製
〜養子免疫療法への応用に期待〜
要約:
- 免疫細胞を体外で培養・活性化して移植する治療法(養子免疫療法)が、注目されている
- しかしT細胞を刺激し増殖する過程で、細胞の疲弊や老化が課題となっている
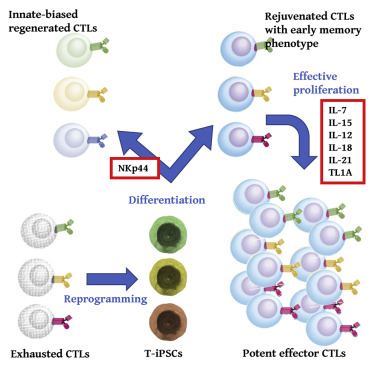
- iPS細胞技術を利用して、「より高い増殖性をもつキラーT細胞のクローンを作ること」に成功した
養子免疫療法:
がんやHIV/AIDSなどの慢性感染症に対する強力な手段として期待されています。
しかし、
- 大量のT細胞を製造する段階で、
- 細胞の疲弊や老化、分化により、
- 増殖能力が低くなることが課題になっています。
分化誘導方法を改良
そこで、分化誘導方法を改良することで、
- 高い自己複製能を持つ、
- 強力なエフェクターT細胞を使い、
- 初期の記憶T細胞の特徴を示す、iPSC-CTLを作製しました。
最適条件で増殖培養:
iPSC-CTLは、最適化された条件で増殖培養すると、1015倍以上に増殖しました。
- 今回の手法で作製したiPSC-CTLを用いて、
- 再分化・拡大培養をすることにより、
- 自家移植でも同種移植でも、
「記憶T細胞とエフェクターT細胞を供給できる」と期待されます。
この研究成果:
2021年10月6日付で「Molecular Therapy」に掲載されました。
ニュース|CiRA | 京都大学 iPS細胞研究所
https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/211013-160000.html
Generation of highly proliferative, rejuvenated cytotoxic T cell clones through pluripotency reprogramming for adoptive immunotherapy
Adoptive immunotherapy
has emerged as a powerful approach to cure cancer and chronic infections.
Currently, the generation of a massive number of T cells that provide long-lasting immunity
is challenged by exhaustion and differentiation-associated senescence, which inevitably arise during in vitro cloning and expansion.
To circumvent these problems,
several studies have proposed an induced pluripotent stem cell (iPSC)-mediated rejuvenation strategy to revitalize the exhausted/senescent T cell clones.
Because iPSC-derived cytotoxic T lymphocytes (iPSC-CTLs) generated via commonly
used monolayer systems have unfavorable, innate-like features such as aberrant natural killer (NK) activity and limited replication potential,
we modified the redifferentiation culture to generate CD8αβ+CD5+CCR7+CD45RA+CD56−-adaptive iPSC-CTLs.
The modified iPSC-CTLs
exhibited early memory phenotype, including high replicative capacity and the ability to give rise to potent effector cells.
In expansion culture with an optimized cytokine cocktail,
iPSC-CTLs proliferated more than 1015-fold in a feeder-free condition.
Our redifferentiation and expansion package of early memory iPSC-CTLs
could supply memory and effector T cells for both autologous and allogeneic immunotherapies.Molecular Therapy