九大・理研:細胞を卵子にする遺伝子:不妊治療にiPS応用(動画):
Kyushu Univ: Genes that turn cells into eggs: iPS for infertility treat:
九州大学理化所:将细胞转化为卵的基因:iPS在不育症治疗中的应用
九州大、理化学研究所:
細胞を「卵子」にする遺伝子:
卵子に含まれる特殊な細胞質(卵細胞質)の形成に必要な遺伝子を、特定しました。
短期間に大量作製:
- 胚性幹細胞(ES細胞)や
- 人工多能性幹細胞(iPS細胞)から
短期間に大量に卵細胞質を持つ細胞(卵子様細胞)を作ることに成功した。
論文は20日までに英科学誌ネイチャーに掲載された。
時事ドットコム
https://www.jiji.com/jc/article?k=2021012000257&g=soc
卵子をかたち作る遺伝子群を同定
九州大学大学院医学研究院:林教授、浜崎助教(ワシントン大学)、
理化学研究所:北島チームリーダー
研究成果:
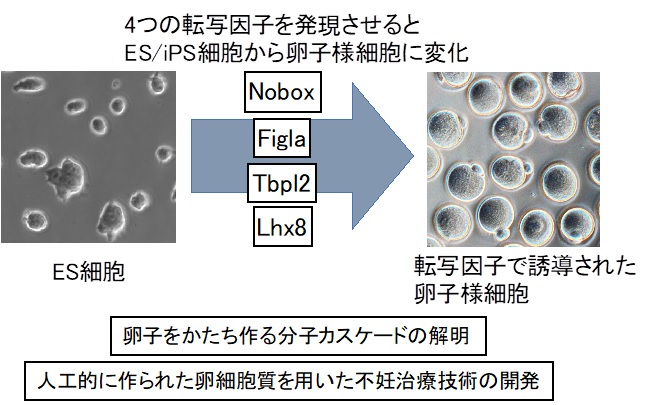
マウスの卵子をかたち作る遺伝子群を同定。
この遺伝子群を胚性幹(ES)細胞や人工多能性幹(iPS)細胞に導入。
短期間のうちに、大量の卵子様細胞を作製することに成功しました。
8つの遺伝子(転写因子):
卵子ができあがる過程を丹念に調べた。
結果、卵細胞質の形成に必要な8つの遺伝子(転写因子)を突き止めました。
驚くべきことに:
- その8つの遺伝子をES細胞やiPS細胞に発現させると、
- 急激に細胞質が成長し、
- 受精能をもった卵子様細胞に変化しました。
短期間で大量作製:
「生物学・医学的に貴重な卵細胞質」を、これまでより短期間で大量に作製することができます。
この成果により:
「個体の発生に必要な卵細胞質の形成機構の解明」や、
「人工的に作られた卵細胞質を用いた不妊治療技術の開発」が期待されます。
本研究成果:
2020年12月16日(水)16時(英国標準時間)に国際学術雑誌「Nature」に掲載されました。
九州大学(KYUSHU UNIVERSITY)
https://www.kyushu-u.ac.jp/ja/researches/view/538
Nature volume 589, pages264–269(2021)
Cite this article 15k Accesses 1 Citations 543 Altmetric Metrics details
Reconstitution of the oocyte transcriptional network with transcription factors
Abstract
During female germline development, oocytes
become a highly specialized cell type and form a maternal cytoplasmic store of crucial factors.
Oocyte growth
is triggered at the transition from primordial to primary follicle and is accompanied by dynamic changes in gene expression1, but the gene regulatory network that controls oocyte growth remains unknown.
Here we identify a set of transcription factors that are sufficient to trigger oocyte growth.
By investigation of the changes in gene expression and functional screening using an in vitro mouse oocyte development system,
we identified eight transcription factors, each of which was essential for the transition from primordial to primary follicle.
Notably, enforced expression of these transcription factors
swiftly converted pluripotent stem cells into oocyte-like cells that were competent for fertilization and subsequent cleavage.
These transcription-factor-induced oocyte-like cells were formed without
specification of primordial germ cells, epigenetic reprogramming or meiosis,
and demonstrate that oocyte growth and lineage-specific de novo DNA methylation are separable from the preceding epigenetic reprogramming in primordial germ cells.
This study
identifies a core set of transcription factors for orchestrating oocyte growth, and provides an alternative source of ooplasm, which is a unique material for reproductive biology and medicine.
Nature