iPS cells: 骨格のもと作製!
créer la base du squelette !
Erstellen der Basis des Skeletts!
creating the base of the skeleton!
iPS 細胞:創造骨骼的基礎!
ー脊椎疾患の治療法開発へー
京都大学:
iPS細胞を使い、受精卵(胚)の内部で、
骨格や筋肉のもとになる細胞の塊、「体節」のモデルを作製した。
12月21日、英科学誌ネイチャーに発表した。
人の胚を使った研究:
生命尊重の観点から人の胚を使った研究は厳しく制限されている。
今回の手法により、
- 人の胚を使うことなく、
- 胚が胎児に成長する過程の解明や、
- 先天性の脊椎疾患の治療法開発につながる。
試験管内で体節モデル作製:
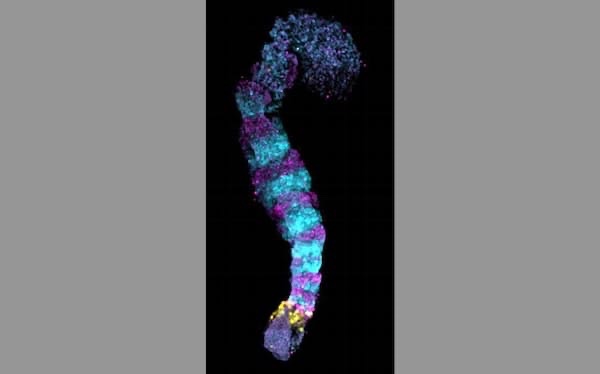
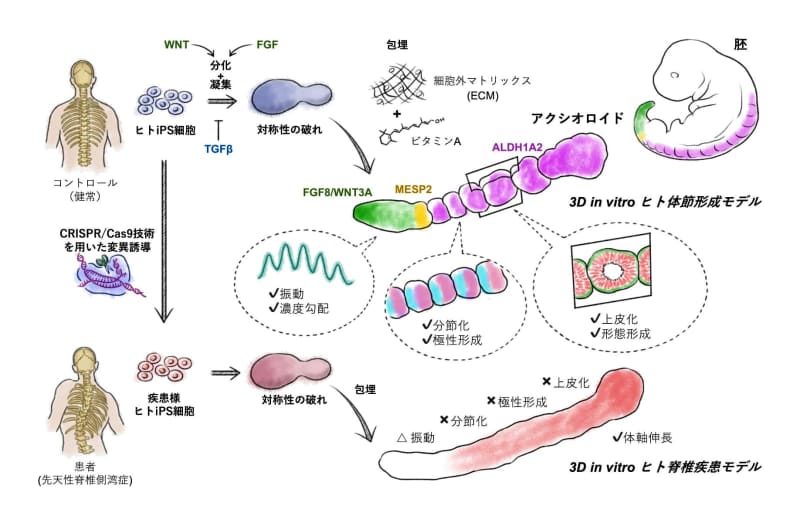
人のiPS細胞を集めた塊を立体的に培養し、試験管内で体節のモデルを作製した。
- 人の胚のものと形態が似ている。
- 同様の遺伝子が発現していることも確認。
iPS細胞で病態再現:
「先天性脊椎疾患患者にみられる遺伝子変異を持たせたiPS細胞」で、
このモデルを作製し、疾患の病態を再現したとのこと。
研究チームは「生物発生の仕組みの理解につなげたい」としている。
日本経済新聞
https://www.nikkei.com/article/DGXZQOUF21ANT0R21C22A2000000/
Cellules iPS : créer la base du squelette !
ーVers le développement de traitements pour les maladies de la colonne vertébraleー
Université de Kyôto :
À l’aide de cellules iPS, à l’intérieur d’un œuf fécondé (embryon),
Nous avons créé un modèle de somite, une masse de cellules qui forment la base du squelette et des muscles.
Le 21 décembre, il a été annoncé dans la revue scientifique britannique Nature.
Études avec des embryons humains :
La recherche utilisant des embryons humains est strictement encadrée du point de vue du respect de la vie humaine.
Par cette méthode,
sans utiliser d’embryons humains.
élucidation du processus par lequel un embryon se transforme en fœtus,
Cela conduira au développement de traitements pour les troubles rachidiens congénitaux.
Modélisation des somites in vitro :
Une masse de cellules iPS humaines a été cultivée en trois dimensions pour créer un modèle somite in vitro.
De forme similaire à celle des embryons humains.
Il a également été confirmé que des gènes similaires étaient exprimés.
Reproduire la pathologie avec des cellules iPS :
“Cellules iPS avec des mutations génétiques trouvées chez des patients atteints de maladie congénitale de la colonne vertébrale”
Ce modèle a été créé pour reproduire la pathologie de la maladie.
L’équipe de recherche déclare : « Nous aimerions comprendre le mécanisme de la biogenèse.
Nihon Keizai Shimbun
iPS-Zellen: Erstellen der Basis des Skeletts!
ーEntwicklung von Behandlungen für Wirbelsäulenerkrankungenー
Universität Kyoto:
Unter Verwendung von iPS-Zellen in einem befruchteten Ei (Embryo)
Wir haben ein Modell eines Somiten erstellt, einer Masse von Zellen, die die Basis des Skeletts und der Muskeln bilden.
Am 21. Dezember wurde es im britischen Wissenschaftsjournal Nature angekündigt.
Studien mit menschlichen Embryonen:
Forschung mit menschlichen Embryonen ist aus Sicht der Achtung des menschlichen Lebens strengstens untersagt.
Durch diese Methode
ohne Verwendung menschlicher Embryonen.
Aufklärung des Prozesses, durch den sich ein Embryo zu einem Fötus entwickelt,
Dies wird zur Entwicklung von Behandlungen für angeborene Wirbelsäulenerkrankungen führen.
In-vitro-Somit-Modellierung:
Eine Masse menschlicher iPS-Zellen wurde dreidimensional kultiviert, um ein Somitenmodell in vitro zu erstellen.
Ähnlich in der Form wie menschliche Embryonen.
Es wurde auch bestätigt, dass ähnliche Gene exprimiert wurden.
Reproduktion von Pathologien mit iPS-Zellen:
“iPS-Zellen mit genetischen Mutationen bei Patienten mit angeborener Wirbelsäulenerkrankung gefunden”
Dieses Modell wurde erstellt, um die Pathologie der Krankheit zu reproduzieren.
„Wir möchten den Mechanismus der Biogenese verstehen“, sagt das Forschungsteam.
Nihon Keizai Shimbun
Reconstituting human somitogenesis in vitro
Nature
Abstract
The segmented body plan of vertebrates is established during somitogenesis, a well-studied process in model organisms,
but remains largely elusive in humans due to ethical and technical limitations.
Despite recent advances with pluripotent stem cell (PSC)-based approaches1-5,
models that robustly recapitulate human somitogenesis in both space and time are still largely missing.
Here,
we introduce a PSC-derived mesoderm-based 3D model of human segmentation and somitogenesis, which we termed ‘axioloid’,
that captures accurately the oscillatory dynamics of the segmentation clock and the morphological and molecular characteristics of sequential somite formation in vitro.
Axioloids show proper rostrocaudal patterning of forming segments
and robust anterior-posterior FGF/WNT signaling gradients and retinoic acid (RA) signaling components.
We identify an unexpected critical role of RA signaling in the stabilization of forming segments, indicating distinct,
but also synergistic effects of RA and extracellular matrix (ECM) on the formation and epithelialization of somites.
Importantly,
comparative analysis demonstrates striking similarities of axioloids to the human embryo, further validated by the presence of a HOX code in axioloids.
Lastly,
we demonstrate the utility of axioloids to study the pathogenesis of human congenital spine diseases,
by using patient-like iPSCs with mutations in HES7and MESP2.
These results suggest that axioloids represent a promising novel platform to study axial development and disease in humans.