The University of Tokyo: Creating iPS cells from cancer cells:
-Expectations for application of cancer therapeutic agents-
cancer cell:
It is known that “cancer cells do not become iPS cells by the usual method”.
but,
By using a drug that stops the action of cancer cells,
The University of Tokyo group has found that iPS cells can be produced.
Institute of Medical Science, University of Tokyo
Professor Yasuhiro Yamada
This was announced by a group of Professor Yasuhiro Yamada of the Institute of Medical Science, University of Tokyo.
It can be applied to the technique of searching for new therapeutic agents for cancer.
Creating iPS cells from cancer cells:
Cancer cells
It is known that iPS cells do not change even if they are used in the same way as normal cells.
Research group:
In an experiment using a mouse,
“The ability to stop the function of genes peculiar to cancer cells and produce iPS cells from cancer cells”
It means that you have found out.
NHK | Medical
https://www3.nhk.or.jp/news/html/20220504/k10013611081000.html
L’Université de Tokyo : Créer des cellules iPS à partir de cellules cancéreuses :
-Attentes pour l’application d’agents thérapeutiques anticancéreux-
cellule cancéreuse :
Il est connu que “les cellules cancéreuses ne deviennent pas des cellules iPS par la méthode habituelle”.
mais,
En utilisant un médicament qui arrête l’action des cellules cancéreuses,
Le groupe de l’Université de Tokyo a découvert que des cellules iPS pouvaient être produites.
Institut des sciences médicales, Université de Tokyo
Professeur Yasuhiro YamadaCela a été annoncé par un groupe du professeur Yasuhiro Yamada de l’Institut des sciences médicales de l’Université de Tokyo.
Elle peut être appliquée à la technique de recherche de nouveaux agents thérapeutiques contre le cancer.
Créer des cellules iPS à partir de cellules cancéreuses :
Cellules cancéreuses
On sait que les cellules iPS ne changent pas même si elles sont utilisées de la même manière que les cellules normales.
Groupe de recherche:
Dans une expérience utilisant une souris,
“La capacité d’arrêter la fonction des gènes propres aux cellules cancéreuses et de produire des cellules iPS à partir de cellules cancéreuses”
Cela signifie que vous avez découvert.
NHK | Médical
Die Universität Tokio: Herstellung von iPS-Zellen aus Krebszellen:
-Erwartungen an die Anwendung von Krebstherapeutika-
Krebszelle:
Es sei bekannt, dass “Krebszellen nicht auf dem üblichen Weg zu iPS-Zellen werden”.
sondern,
Durch die Verwendung eines Medikaments, das die Wirkung von Krebszellen stoppt,
Die Gruppe der Universität Tokio hat herausgefunden, dass iPS-Zellen hergestellt werden können.
Institut für Medizinische Wissenschaft, Universität Tokio
Professor Yasuhiro YamadaDies teilte eine Gruppe von Professor Yasuhiro Yamada vom Institute of Medical Science der Universität Tokio mit.
Es kann auf die Technik der Suche nach neuen therapeutischen Mitteln für Krebs angewendet werden.
Herstellung von iPS-Zellen aus Krebszellen:
Krebszellen
Es ist bekannt, dass sich iPS-Zellen auch dann nicht verändern, wenn sie wie normale Zellen verwendet werden.
Forschungsgruppe:
In einem Experiment mit einer Maus
“Die Fähigkeit, die Funktion von Krebszellen eigenen Genen zu stoppen und iPS-Zellen aus Krebszellen zu produzieren”
Es bedeutet, dass Sie es herausgefunden haben.
NHK | Medizin
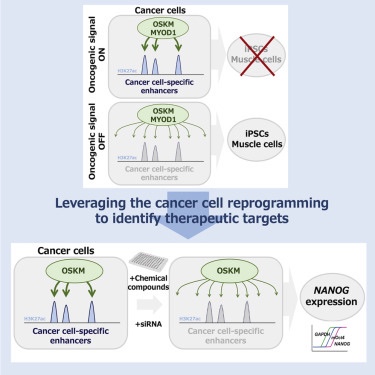
The oncogene-dependent resistance to reprogramming unveils cancer therapeutic targets:
Cell Reports
Summary
The resistance to transcription factor-mediated reprogramming into pluripotent stem cells
is one of the distinctive features of cancer cells.
Here we dissect
the profiles of reprogramming factor binding and the subsequent transcriptional response in cancer cells to reveal its underlying mechanisms.Using clear cell sarcomas (CCSs),
we show that the driver oncogene EWS/ATF1misdirects the reprogramming factors to cancer-specific enhancers and therebyimpairs the transcriptional response toward pluripotency that is otherwise provoked.
Sensitization to the reprogramming cue
is observed in other cancer types when the corresponding oncogenic signals are pharmacologically inhibited.
Exploiting this oncogene dependence of the transcriptional “stiffness,”
we identify mTOR signaling pathways downstream of EWS/ATF1 and discover that inhibiting mTOR activity substantially attenuates the propagation of CCS cells in vitro and in vivo.
Our results demonstrate
that the early transcriptional response to cell fate perturbations can be a faithful readout to identify effective therapeutics targets in cancer cells.